8月9日,中国科大生医学部薛天教授团队在生医顶级期刊《CELL》发表研究论文。本周内,中国科大生医学部集齐了Nature\Science\Cell正刊。
Cell

婴幼儿在成长发育早期接受的感觉刺激(包括视觉、听觉,触觉等)对促进其大脑高级认知功能的发育至关重要。作为人类最重要的感知觉输入,发育早期视觉(光)感知能促进多脑区的协同发育和高级脑功能的形成。先前的研究显示,出生后即完全避光暗饲养会导致幼鼠多个感知觉皮层突触形成的减缓,其中神经肽催产素(oxytocin)可能是介导该过程的关键分子。然而,在发育早期视觉(光)是如何被感知、并通过何种神经环路和分子机制促进了多脑区协同发育、以及幼年的视觉(光)剥夺对成年高级脑功能的影响尚不清晰。
哺乳动物的视觉感知起始于视网膜。哺乳动物视网膜中主要存在三类感光细胞:视杆细胞(rods)、视锥细胞(cones)和视网膜自感光神经节细胞(intrinsicallyphotosensitiveretinalganglioncells, ipRGCs)。不同于介导视觉图像编码的经典成像视觉感光细胞(视杆细胞和视锥细胞),ipRGCs通过其基因Opn4编码的感光蛋白视黑素(melanopsin)特异性感知蓝光波段的光,并主要介导非成像视觉功能,如昼夜节律光调节、瞳孔光反射和光调控情绪等。在发育过程中,ipRGCs是最早具有感光功能的视网膜感光细胞,这暗示ipRGCs可能是介导光促进幼年大脑发育最关键的感光细胞。
研究人员首先通过敲除编码ipRGCs感光蛋白的基因Opn4,发现缺失ipRGCs感光能力(Opn4-/-)的新生鼠在出生后发育早期,其多个感觉皮层和海马椎体神经元的自发微小兴奋性突触后电流(mEPSC)频率显著降低,且形态学显示椎体神经元的树突棘(spine)数量也显著减少;而在出生后即完全避光暗饲养的实验中,对照组与Opn4-/-新生鼠皮层和海马的突触功能与数量没有显著差异。这一结果提示,ipRGCs在出生后可能介导了光促进大脑突触发生的现象。进一步,通过在Opn4-/-新生鼠视网膜ipRGCs中重新快速表达感光蛋白melanopsin,可以促进其皮层和海马的突触发生的显著提高,证明在发育早期,ipRGCs是介导小鼠早期光感受促进脑高级认知区域突触发生的充分且必要的条件(图1)。
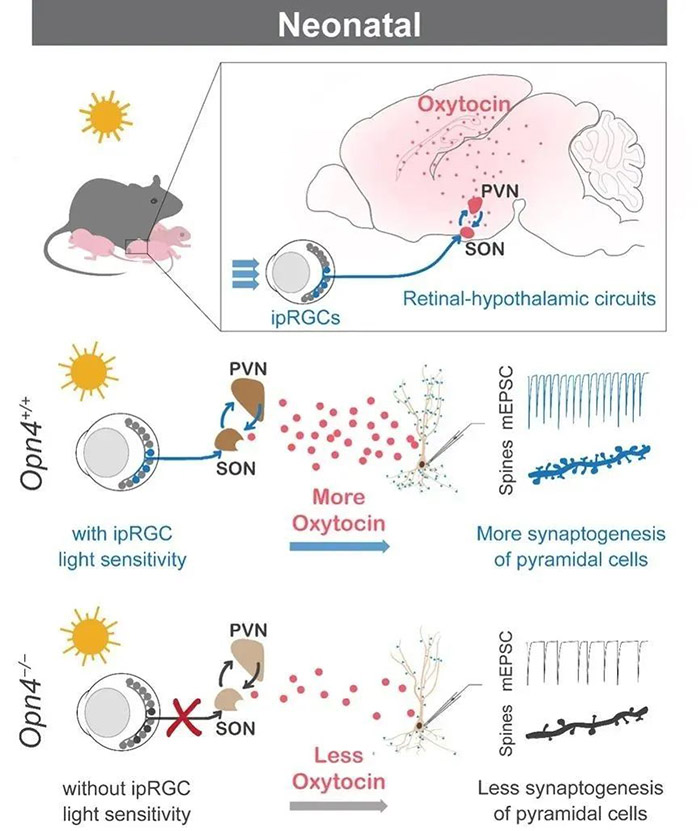
图1:发育早期ipRGCs介导的光感知通过激活视上核(SON)和室旁核(PVN)的催产素神经元,促进不同大脑高级认知区域(大脑皮层、海马等)神经元突触的协同发育。
为了进一步探究ipRGCs的光感知促进皮层和海马突触发生的环路和分子机制,研究人员通过质谱检测、新生小鼠脑及视网膜神经示踪和调控,发现当ipRGCs被光激活后,会通过视网膜至下丘脑的ipRGCs-视上核(SON)-室旁核(PVN)神经环路,激活视上核和室旁核的催产素神经元,进而提升了脑脊液中的催产素浓度;而催产素作为神经元突触建立的关键调控分子之一,直接促进了多个大脑皮层和海马的突触形成(图1)。
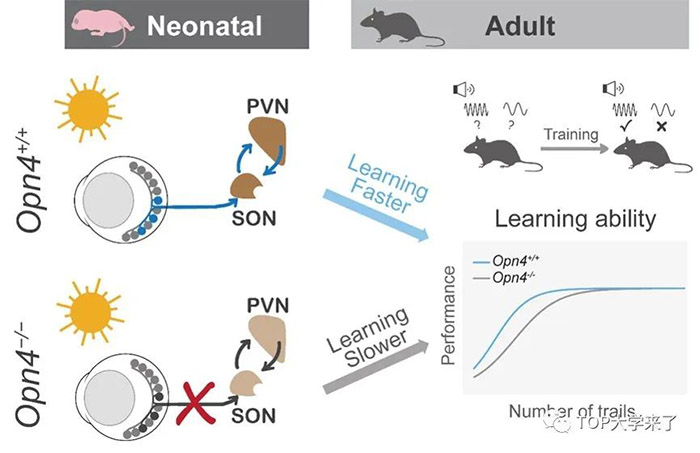
为了探究发育早期光促进脑突触发育对成年后高级脑认知能力的影响,研究人员通过训练小鼠学习不同频率的声音刺激与奖励/惩罚的相关性(Go/No-go行为学),发现幼年期ipRGCs光感受的缺失,会导致小鼠成年后的学习速度显著下降(图2),而这种成年后学习能力的缺陷可以被幼年时人为激活ipRGCs或视上核的催产素神经元所挽救。
综上,这项研究发现了发育早期视觉(光)感知促进大脑高级认知区域神经元突触协同发育的感光、神经环路和分子机制,并揭示了发育早期光感知对成年脑高级认知能力的影响。该研究成果提示公共卫生研究应关注新生儿日常的光环境,进一步探索光环境对新生儿大脑发育的影响。
研究团队表示,下一步团队将继续深入探索发育早期的光输入对哺乳动物健康和生存的影响,为优化新生儿成长发育的环境提供科学依据。
Science
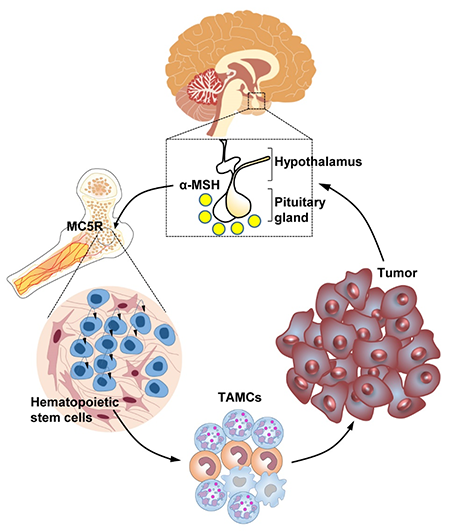
8月4日,中国科学技术大学生命科学与医学部周荣斌、江维教授团队与转化医学与创新药物国家重点实验室唐任宏团队合作,在全球顶级期刊《Science》以“First Release”的形式在线发表题为“Pituitary hormone α-MSH promotes tumor-induced myelopoiesis and immunosuppression”的“Research Article”研究论文,报道了下丘脑-垂体轴及其产生的激素α-MSH在介导肿瘤诱导的髓系造血和免疫抑制中的关键作用。

中国科学技术大学博士研究生胥月丽和颜家贤为该论文的共同第一作者。中国科学技术大学生命科学与医学部、中科院天然免疫与慢性疾病重点实验室和微尺度物质科学国家研究中心周荣斌、江维和转化医学与创新药物国家重点实验室唐任宏为该论文的共同通讯作者。
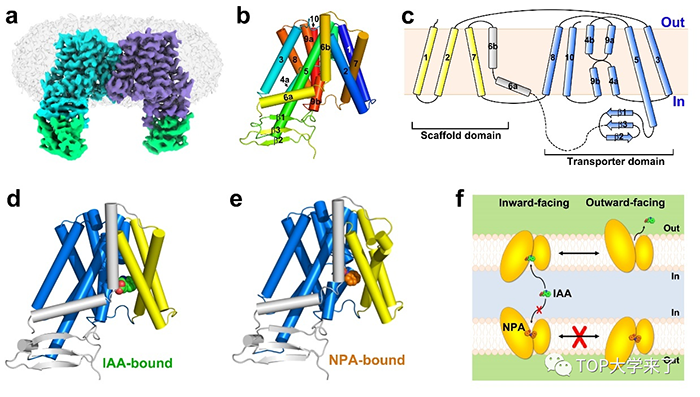
肿瘤诱导的免疫抑制是其逃避免疫监视和攻击的重要原因。靶向PD-1和CTLA-4等靶点的免疫检查点治疗(ICT)策略在一定程度上能够逆转肿瘤免疫抑制并取得了较好的治疗效果,但临床响应性还比较低,需要进一步揭示肿瘤免疫抑制机制并寻找新的免疫治疗靶点和策略。 综上所述,该研究发现肿瘤通过诱导下丘脑PVH神经元激活和垂体α-MSH产生促进肿瘤诱导的髓系造血和免疫抑制。研究的创新性体现在:1)发现一条介导肿瘤免疫抑制的神经内分泌通路:下丘脑-垂体-骨髓(HPB)轴;2)发现MC5R作为一个新的应激受体感应下丘脑-垂体信号促进髓系造血;3)发现MC5R可以作为一个潜在的肿瘤免疫治疗新靶点。 肿瘤患者经常遭受抑郁、恐惧、焦虑等精神或情感应激,且流行病学研究发现长期抑郁、压力会加速肿瘤的发展并削弱肿瘤免疫治疗的效果,表明神经系统及其介导的应激反应在肿瘤生长和免疫调控中发挥重要作用。下丘脑-垂体(HP)轴是神经内分泌系统的重要组成部分,也是机体感应应激反应的重要调节中枢。过去的研究发现HP可通过产生激素如促肾上腺皮质激素、促甲状腺激素和催乳素调节免疫反应。此外,在肿瘤患者中HP产生的雌激素、孕激素和糖皮质激素等一些下游激素或效应物显著升高,提示神经内分泌系统和HP轴可能调节肿瘤免疫,但是HP轴在肿瘤免疫中的作用及免疫系统感应肿瘤诱导的神经应激的机制尚不清楚。 在该项研究中,研究人员通过构建不同的肿瘤模型(ICT抵抗的LLC和B16F10-GMCSF肿瘤以及敏感的MC38和MCA205肿瘤)来研究下丘脑-垂体轴在肿瘤免疫中的作用,发现荷瘤小鼠血清中α-MSH浓度显著升高,但垂体产生的其他激素如内啡肽、促甲状腺激素、催乳素、卵泡刺激素、黄体生成素等无显著差异。与此同时,研究人员发现荷瘤小鼠下丘脑室旁核(PVH)神经元被激活,并且垂体中叶负责编码α-MSH合成的蛋白POMC的表达也显著增强,表明肿瘤可促进下丘脑活化和垂体α-MSH产生。 为了进一步研究POMC及其产物α-MSH在肿瘤免疫中的作用,研究人员利用立体定位注射腺病毒载体的的方式敲低垂体Pomc基因的表达,随后进行荷瘤实验。结果显示敲低垂体Pomc的表达能够显著抑制不同皮下肿瘤的生长。同时,在B16F10肺转移模型和LLC原位肿瘤模型中,敲低垂体Pomc的表达也能够显著抑制肺部转移灶数目和肺部结节数量。进一步研究人员发现敲低垂体Pomc表达能够增强抗肿瘤免疫能力,同时抑制髓系造血和肿瘤相关髓系细胞(MDSCs和TAMs等)的聚集。这些结果表明垂体来源的α-MSH通过诱导髓系造血和免疫抑制促进肿瘤生长。 为了探究α-MSH通过何种受体参与调控肿瘤诱导的髓系造血和免疫抑制,研究人员检测了α-MSH的受体的表达情况,发现MC5R在骨髓造血前体细胞高表达。通过构建Mc5r全身或条件型缺陷小鼠进行荷瘤实验,研究人员发现Mc5r缺陷可以显著地增强抗肿瘤免疫并抑制不同类型肿瘤的发生发展。此外,Mc5r缺陷可以抑制肿瘤诱导的髓系造血。更为重要的是,不管是ICT敏感还是抵抗的肿瘤模型中,利用多肽抑制剂阻断MC5R均可抑制肿瘤生长,且MC5R多肽抑制剂与抗PD-1抗体联合使用可提高ICT的效率。 最后,研究人员探讨了上述研究的临床相关性,发现非小细胞肺癌(NSCLC)和恶性头颈癌(HNC)患者血清中α-MSH浓度显著升高并与外周血中的MDSCs比例呈正相关。 Nature 08月02日,中国科学技术大学生命科学与医学部孙林峰教授团队在全球顶级期刊《Nature》上发表了题为“Structural insights into auxin recognition and efflux byArabidopsisPIN1”的研究论文,报道了植物中生长素极性转运蛋白PIN1单独的(apoform),与底物生长素结合的(IAA-bound),以及与抑制剂NPA(N-1-naphthylphthalamic acid,又名抑草生)结合的(NPA-bound)三个高分辨率结构,并结合功能实验阐释了PIN1蛋白的工作机制,为理解植物生长素运输调控、以及针对PIN蛋白的农业用除草剂和植物生长调节剂的设计开发提供了重要基础。 早在1880年,达尔文父子在《植物的运动力》(“ThePower of Movements in Plants”)一书中,就提出了植物茎顶端会产生某种物质,导致“向光性”生长的猜想。1928年荷兰科学家F.Went通过著名的“温特实验”(燕麦胚芽鞘弯曲实验)证实了这种物质的存在并首次提出了“生长素”的概念。科学家进一步的研究确定植物中主要的生长素为吲哚-3-乙酸(IAA, Indole-3-acetic acid)。 作为第一种被发现的植物激素,生长素几乎参与了植物生长发育调控的每一个过程,比如胚胎发育、根发育、叶发育、花发育、向光性和向重力性等。区别于其它植物激素,生长素的一个非常显著的特点是其细胞与细胞间的运输过程具有方向性,这一过程也被称为生长素极性运输(Polar Auxin Transport, PAT)。生长素极性运输通过与其合成和代谢途径共同配合,产生浓度梯度和局部浓度差异,建立调控植物生长发育、“向性生长”的基础,响应内外界信号刺激。在生长素极性运输过程中,位于膜上的转运蛋白发挥了关键作用,其中生长素外排蛋白家族PIN(PIN-FORMEDauxin exporter)尤为重要。研究表明,PIN蛋白成员在细胞质膜上具有不对称分布的特点,其极性定位与生长素运输方向高度关联,是生长素在植物体内不对称分布的重要原因。由于缺乏精细的三维结构,PIN家族蛋白特异性识别、转运生长素的机制一直未知,也是生长素研究领域亟待解决的关键科学问题。NPA是之前在实验室广泛应用的一种生长素极性运输抑制剂,也是农业生产中最早作为除草剂应用的化学小分子。生化证据表明,NPA可以直接靶向PIN蛋白,但是究竟是如何发挥作用的一直不清楚。 图1. 拟南芥PIN1蛋白三种状态下的结构和转运机制示意图。 在模式植物拟南芥中,PIN家族包括8个蛋白成员,包括经典的、主要分布于细胞膜上的、具有较长胞质loop环的PIN成员(PIN1~PIN4和PIN7),非经典的、分布于内质网上的、具有较短胞质loop环的PIN成员(PIN5和PIN8),以及胞质loop环长度介于二者之间的PIN6蛋白。PIN1是最早鉴定的PIN家族成员之一,其基因突变导致植物产生裸露的针状(pin-formed)花序,该家族由此得名。在本研究中,孙林峰团队针对PIN1这一经典的PIN家族成员展开研究,首先搭建了一套全新的、基于放射性同位素和哺乳动物HEK293T细胞的、检测PIN1蛋白生长素外排功能的生化体系,不仅验证了其转运活性,证实了PIN1受蛋白激酶激活调控、被NPA抑制的过程,也为PIN介导的生长素运输机制研究提供了一种可靠的便捷手段。此外,团队还利用质谱分析技术,鉴定了多个位于胞质loop环的磷酸化位点,为进一步研究PIN受磷酸化调控的机制提供了线索。 在功能分析的同时,团队利用HEK293F细胞瞬时表达系统表达、纯化得到了拟南芥PIN1蛋白。为了解决蛋白构象不稳定及分子量较小的问题,孙林峰团队与中国科学院分子细胞科学卓越创新中心李典范团队合作,利用体外纳米抗体合成技术,得到了大量靶向PIN1蛋白的纳米抗体,进一步通过亲和力、热稳定性分析缩小了抗体筛查范围。最终,团队利用冷冻电镜单颗粒重构技术,成功解析了PIN1与一种纳米抗体结合的、分辨率为3.0埃的结构,首次揭示了经典PIN家族蛋白成员的样貌。PIN1以对称性的同源二聚体方式组装。每个PIN1单体具有10次跨膜螺旋,呈现出典型的NhaA蛋白折叠方式,划分为Scaffold结构域和Transporter结构域。PIN1呈现向细胞质侧开放的构象,同时在胞质侧,还具有一个由b折叠片组成的结构域,区别于近期报道的同家族成员PIN8蛋白的结构。通过在蛋白中添加底物IAA和抑制剂NPA,团队又分别得到了PIN1蛋白分别与两种小分子结合的复合物结构。在这些结构中,清楚地看到了IAA和NPA结合的结合位点以及相互作用氨基酸残基,并通过突变、ITC结合常数测定和转运分析验证了这些残基的重要性。虽然IAA和NPA在结合方式上具有一定相似性,但是由于NPA分子更大,通过与PIN1产生更多的氢键和疏水性相互作用,以一种亲和力更高的方式结合,并使蛋白处于朝内侧开放的构象,从实验上验证了NPA的高效抑制作用。除此之外,团队还讨论了PIN家族蛋白转运IAA的驱动力和能量来源,通过转运实验分析,发现跨膜质子梯度对于IAA运输影响较小,暗示PIN不依赖于质子梯度提供能量。 综上,该研究揭开了植物经典PIN家族蛋白的结构面纱,系统阐释了PIN1识别底物生长素IAA以及被NPA抑制的分子机制,为我们深入理解植物生长素极性运输过程提供了重要帮助,也为基于靶向该家族蛋白的小分子抑制剂设计奠定了基础,对于指导农业应用具有重要意义。 本文内容综合自TOP大学来了,nature、science、cell、中国科学技术大学、中国科大新创校友基金会